Работа с гаметами
Назначением этой группы сред и буферов является подготовка гамет человека для оплодотворения in vitro/ИКСИ процедуре, т.е. к получению зиготы.

РАБОТА С ГАМЕТАМИ
Назначением этой группы сред и буферов является подготовка гамет человека для оплодотворения in vitro/ИКСИ процедуре, т.е. к получению зиготы.
Номера по каталогу:
Универсальный буфер для гамет K-SIGB-50 K-SIGB-100
Универсальный буфер для гамет приготовлен на основе HEPES буфера и предназначен для подготовки ооцитов и сперматозоидов. Подходит для большинства техник выделения сперматозоидов, особенно для отмывки, разделения в градиенте плотности и для разведения 100% градиента. Используется для отмывки ооцит-кумулюсного комплекса (ОКК) перед помещением ооцитов в бикарбонатный буфер для оплодотворения. При подготовке к процедуре ИКСИ может быть использован для денудации ооцита.
Среда для сперматозоидов K-SISM-20 K-SISM-50, K-SISM-100
Среда для приготовления сперматозоидов на основе бикарбонатного буфера предназначена для выделения сперматозоидов отмывкой или в градиенте плотности, когда требуется работа в 6% CO2.
Градиент плотности для сперматозоидов K-SISG-20 K-SISG-50
Градиент плотности используется для выделения сперматозоидов методом разделения в градиенте плотности. Градиент плотности включает два раствора 40% и 80%.
Буфер для криоконсервации сперматозоидов K-SISC-20
Буфер для криоконсервации сперматозоидов на основе HEPES с глицерином в качестве криопротектора предназначен для заморозки отмытых сперматозоидов, MESA и TESA биоптатов. Не используется для заморозки нативной спермы.
Буфер для промывания фолликулов K-SIFB-100
Буфер для промывания фолликулов на основе HEPES, не содержит ЧСА и гепарин, предназначен для промывки фолликулов при процедуре аспирации ооцитов. Гепарин может быть добавлен в буфер в случае необходимости.
Набор для криоконсервации ооцитов K-OCF-5000
Набор для криоконсервации ооцитов на основе HEPES-буфера, предназначен для замораживания ооцитов на стадии MII.
Набор для размораживания ооцитов K-OCT-5000
Набор для размораживания ооцитов на основе HEPES-буфера, предназначен для размораживания ооцитов.
Протокол подготовки спермы
Существует несколько способов выделения сперматозоидов, таких, как отмывка и центрифугирование в градиенте плотности. В разных лабораториях придерживаются различных способов, но наиболее хорошие результаты можно получить при выделении сперматозоидов в градиенте плотности.
Ключевые моменты
- Сперма должна быть подготовлена в течение одного часа после получения.
- Нативная сперма не должна центрифугироваться, т.к. потенциально токсичные клетки и мертвые сперматозоиды концентрируются вместе с подвижными сперматозоидами и могут оказывать негативный эффект.
Центрифугирование в градиенте плотности
- Разделение в градиенте плотности основано на различном удельном весе и плотности. При центрифугировании различные клетки занимают определенное положение, в котором их плавучая плотность соответствует плотности градиента.
- Разделение основано на том, что зрелые сперматозоиды имеют плотную упаковку ДНК и большую плотность, чем 80% раствор, поэтому проходят сквозь него и оседают на дне пробирки.
- Градиент плотности состоит из суспензии силиконовых частиц, покрытых силаном в Универсальном буфере для гамет (K-SIGB).
- Набор градиента плотности для сперматозоидов (K-SISG) состоит из двух растворов: 40% и 80%, готовых для использования.
Методика
1. Инкубируйте сперму при температуре 37oC в течение примерно 30 минут для разжижения.
2. Возьмите аликвоту для лабораторного исследования.
3. Подготовьте два градиента, используя необходимые объемы компонентов градиента, подогретого до комнатной температуры (напр., 1.5 мл 40% компонента и 1.5 мл 80-% компонента) в пробирке с коническим дном.
4. Для достижения наилучших результатов градиент следует готовить непосредственно перед использованием.
5. Для того чтобы получить максимальное количество сперматозоидов, добавьте 60% или до 2.0 мл эякулята в первый градиент и до 40% или до 1.2 мл во второй.
6. Центрифугируйте градиенты в течение 20 минут при 300 g, затем осторожно удалите семенную плазму, верхнюю интерфазу, 40-% слой и нижнюю интерфазу. Оставьте основную часть 80-% слоя в сосуде.
7. С помощью чистой пипетки Пастера, погруженной в 80-% слой, аспирируйте осадок и ресуспендируйте его в 3 мл Универсального буфера для гамет.
8. Центрифугируйте 10 мин. при 600 g.
9. Повторите отмывку с 3 мл Универсального буфера для гамет.
10. Удалите супернатант и ресуспендируйте в небольшом объеме (около 200 мкл.) Среды для приготовления сперматозоидов или Среды для оплодотворения.
11. Подсчитайте количество сперматозоидов и вычислите концентрацию. При необходимости сделайте разведение. Храните в инкубаторе при 6% CO2, при 37oС.
Получение подвижных сперматозоидов отмывкой
- Получение подвижных сперматозоидов из нативной спермы отмывкой из центрифугированного осадка. Подвижные сперматозоиды выходят в верхнюю фазу, в наслоенную чистую среду. Этот метод наиболее часто используется со сперматозоидами с нормальным профилем.
- Лучше сначала отмыть сперматозоиды и ресуспендировать осадок перед последующим выделением сперматозоидов отмывкой.
Методика (нативная сперма)
1. Аккуратно наслоите аликвоту полностью разжиженной спермы (100–300 мкл) под 0.5 мл уравновешенной Среды для сперматозоидов (K-SISM) в 5 мл пробирке с круглым дном. Повторите это во второй 5 мл пробирке для увеличения поверхности и увеличения выхода сперматозоидов.
2. Для вязкого образца спермы можно сделать предварительное разведение со средой для сперматозоидов.
3. Поместите пробирки в штатив под углом 60°. Поместите штатив в CO2-инкубатор.
4. Извлеките штатив спустя 20–60 мин. (зависит от качества образца) и отберите часть среды над подлежащей спермой (прим. 0.25 мл). Будьте аккуратны, чтобы не повредить нижний слой и интерфазу.
5. Добавьте 5.0 мл уравновешенной Среды для сперматозоидов к отобранному объему и центрифугируйте при 600 g в течение 10 мин.
6. Отберите осадок и ресуспендируйте в малом объеме уравновешенной Среды для приготовления сперматозоидов или уравновешенной Среды для оплодотворения
(K-SIFM), подсчитайте сперматозоиды и вычислите концентрацию.
7. Храните в 6% CO2-инкубаторе при 37°C.
Методика (отмытые сперматозоиды)
1. Используя стерильную пипетку, отберите образец спермы в коническую пробирку (максимум 3 мл в пробирку) и добавьте по крайней мере такой же объем Универсального буфера для гамет стерильной пипеткой.
2. Центрифугируйте при 300 g в течение 20 мин.
3. Стерильной пипеткой отберите супернатант как можно тщательнее, но стараясь не задеть осадок.
4. Ресуспендируйте осадок в 3 мл Универсального буфера для гамет.
5. Центрифугируйте при 300 g в течение 10 мин.
6. Стерильной пипеткой отберите верхнюю часть супернатанта как можно тщательнее, но стараясь не задеть осадок.
7. Стерильной пипеткой отберите весь супернатант, не трогая осадок.
8. Ресуспендируйте осадок и наслоите стерильной пипеткой 1 мл уравновешенной Среды для сперматозоидов в 5 мл пробирке Falcon.
9. Снимите крышку пробирки и поместите в CO2-инкубатор на 30 минут.
10. Отберите супернатант со «всплывшими» сперматозоидами (прим. 0.25 мл) и перенесите в чистую 5 мл пробирку.
11. Подсчитайте концентрацию, посмотрите подвижность сперматозоидов в образце и сделайте пометки в журнале.
Криоконсервация сперматозоидов
Методика
Подготовка образца
1. Удостоверьтесь, что образец отмытых сперматозоидов и аликвота Буфера для криоконсервации сперматозоидов (K-SISC) нагреты до комнатной температуры.
2. Смешайте два объема буфера и один объем образца отмытых сперматозоидов.
3. Оставьте образец на 10 минут при комнатной температуре.
4. Снабдите соломины для криоконсервации необходимой информацией.
5. Поместите образец отмытых сперматозоидов в соломину или криопробирку и запечатайте согласно инструкции производителя.
Замораживание
Для образцов отмытых сперматозоидов рекомендовано контролируемое замораживание. Образцы могут быть заморожены в парах жидкого азота, поскольку условия могут сильно варьироваться, и любой подходящий метод может использоваться в каждой индивидуальной лаборатории.
Соломины
Поместите соломины в замораживатель и запустите программу заморозки. Программа должна приблизительно соответствовать параметрам, указанным ниже.
• Стартовая температура 20°C.
• Скорость заморозки 6°C/мин до -80°C.
• При -80°C поместите в жидкий азот.
Криопробирки
Поместите пробирки в замораживатель и запустите программу заморозки. Программа должна приблизительно соответствовать параметрам, указанным ниже.
• Стартовая температура 20°C.
• Охладить до +5.0°C со скоростью заморозки -0.5°C/мин.
• от +5.0°C до +4.0°C скорость заморозки -1°C/мин.
• от +4.0°C до +3.0°C скорость заморозки -2°C/мин.
• от +3.0°C до +2.0°C скорость заморозки -4°C/мин.
• от +2.0°C до +1.0°C скорость заморозки -8°C/мин
• от +1.0°C до -80.0°C скорость заморозки -10°C/мин.
• При -80°C держите в течение 10 минут.
• Поместите в жидкий азот.
Размораживание
1. Извлеките соломины или криопробирки из жидкого азота и поместите их в пробирку Falcon, 15 мл в штативе при комнатной температуре, пока размораживание не закончится.
2. Распечатайте соломину или криопробирку в соответствии с инструкциями производителя и извлеките размороженный образец.
3. Разведите образец Универсальным буфером для гамет (K-SIGB) 1:1 для снижения токсического эффекта глицерина.
4. Быстро оцените жизнеспособность сперматозоидов. Если необходимо, разморозьте дополнительные соломины для получения образца.
5. В случае заморозки нативной спермы необходимо быстро отделить сперматозоиды в Градиенте плотности для сперматозоидов (K-SISG) или процедурой отмывки с Универсальным буфером для гамет или Средой для сперматозоидов (K-SISM).
Сбор ооцитов
Наибольшая овариальная стимуляция происходит при использовании β-hCG триггера, сбор ооцитов начинается на 34–35-й час после инъекции hCG. Трансвагинальная пункция для аспирации фолликулярного содержимого является стандартным методом для сбора ооцитов.
Ключевые моменты
• Использовать защитные перчатки.
• Работать быстро и эффективно.
• Стараться снизить стресс для ооцитов, работая с подходящими растворами и при нужных условиях. Минимизируйте колебания pH, осмолярности и температуры, чтобы не повредить ооцит-кумулюсный комплекс (ОКК).
• Хранение ОКК в нефизиологичных условиях в течение длительного времени будет иметь негативное действие на процедуру оплодотворения и последующее развитие
эмбриона.
Методика
Без подогрева воздуха в камере.
(Минимальные требования – столик микроскопа с подогревом и штатив с нагревом (K-FTH-1012) для пробирок с фолликулярной жидкостью.)
1. Промойте аспирационную иглу для пункции и аспирационную линию 10 мл Буфером для промывки фолликулов (K-SIFB) до начала аспирации.
2. Буфер для промывки не содержит белка для предотвращения образования пены и пузырей в аспирационной линии. Этот же буфер используется для дополнительной промывки фолликулов, если это требуется.
3. Пробирки с аспирированной фолликулярной жидкостью хранятся перед использованием в нагревателе Соок K-FTH-1012) при температуре тела.
4. В пробирке должно быть не более четырех ооцитов, т.к. при превышении этого количества есть риск изменения газового состава среды, закисления среды как следствие метаболизма кумулюсных клеток.
5. Перелейте содержимое пробирок в нетоксичные чашки Петри диаметром 60 мм для поиска и отбора ОКК.
6. Полученные ОКК отмывают в двух чашках с Универсальным буфером для гамет (K-SIGB) и затем переносят в пробирки с 1 мл уравновешенной Среды оплодотворения (K-SIFM). Пробирки быстро закрываются и убираются в нагревательный блок.
7. Повторите это для всех ОКК, затем перенесите пробирки в лабораторию. Перелейте содержимое пробирок в чашки с уравновешенной Средой оплодотворения. Если ЭКО-лаборатория находится рядом с операционной комнатой, материал может быть помещен сразу в чашки со Средой оплодотворения в инкубатор с 6% CO2 сразу
после отмывки. Рекомендуется использование настольного инкубатора K-MINC-1000.
С камерой с контролируемыми условиями.
1. Промойте аспирационную иглу для пункции и аспирационную линию 10 мл Буфера для промывки фолликулов (K-SIFB) до начала аспирации.
2. Храните каждую пробирку с аспиратом внутри камеры.
3. Перелейте содержимое пробирок в нетоксичные чашки Петри диаметром 60 мм для поиска ОКК.
4. Полученные ОКК отмывают в двух чашках с уравновешенной Средой оплодотворения и помещаются в культуральные плашки с уравновешенной Средой оплодотворения.
5. Повторите это для всех ОКК, затем перенесите в лабораторию и поместите в инкубатор до процедуры оплодотворения.
Криоконсервация ооцитов
Протокол замораживания ооцитов
Набор для криоконсервации ооцитов (K-OCF-5000) – трехступенчатая система для замораживания ооцитов на стадии MII, буфер на основе HEPES с пропандиолом и сахарозой в качестве криопротекторов.
Раствор 1. Буфер для криоконсервации с 0.75М пропандиолом.
Раствор 2. Буфер для криоконсервации с 1.5М пропандиолом.
Раствор 3. Буфер для криоконсервации с 1.5М пропандиолом и 0.2М сахарозой.
Внимание
• Все ооциты должны быть освобождены от кумулюсных клеток и клеток короны.
• Растворы для замораживания используются нагретыми до комнатной температуры (~20°C) перед использованием.
• Все этапы обезвоживания яйцеклетки должны проводиться при комнатной температуре (~20°C).
Методика
1. Промаркируйте соломины соответствующей информацией о пациенте.
2. Перенесите 0.4 мл Раствора 1 в первую лунку 4-луночного планшета, перенесите Растворы 2 и 3 в соответствующие лунки планшета и промаркируйте их. Нагрейте растворы до
комнатной температуры (~20°C).
3. Перенесите ооциты в первую лунку, содержащую Раствор 1, и инкубируйте 7.5 мин.
4. Перенесите ооциты в минимальном объеме Раствора 1 во вторую лунку, содержащую Раствор 2, и тщательно перемешайте. Инкубируйте 7.5 мин.
5. Перенесите ооциты в минимальном объеме Раствора 2 в третью лунку, содержащую Раствор 3, и тщательно перемешайте. Инкубируйте 5 мин.
Раствор Время
Раствор 1 7 мин. 30 с
Раствор 2 7 мин. 30 с
Раствор 3 5 мин.
6. Используя Раствор 3 в третьей лунке как заполняющий раствор, введите ооциты в маркированные соломины.
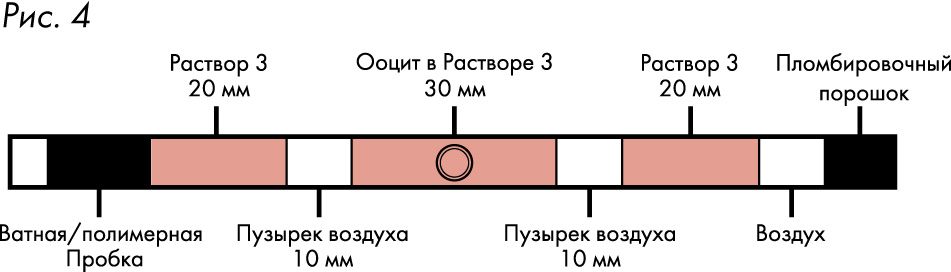
7. Заполните соломину Раствором 3 на 20 мм, затем 10 мм воздуха 30 мм Раствора 3, содержащего ооцит(ы), 10 мм воздуха 20 мм Раствора 3 и в конце – воздух.
8. Как только первый столбик среды коснется ватной пробки, противоположный конец соломины закрывается пробкой, останавливающей все движение в соломине (см. 4).
9. Закройте второй конец соломины пробкой или пломбировочным порошком Seal-easeTM (Becton Dickinson) в соответствии с рекомендациями производителя. Повторите для всех соломин.
Поместите соломины в замораживатель и запустите программу замораживания.
Программа замораживания ооцитов.
• Охлаждайте с +20°C до -8°C со скоростью -2°C/мин.
• Держите при -8°C в течение 10 мин.
• Выполните сиддинг вручную в течение 3 мин. в режиме «удержания» при -8°C
• Охлаждайте с -8°C до -30°C со скоростью -0.3°C/мин.
• Охлаждайте с -30°C до -150°C со скоростью -50°C/мин.
• Держите при -150°C в течение 10 мин.
• Поместите в жидкий азот для длительного хранения.
Сиддинг достигается прикосновением предварительно охлажденного в жидком азоте ватного тампона или пинцета к области раздела жидкость–воздух в соломине для старта кристаллизации.
Протокол размораживания ооцитов
Набор для размораживания ооцитов (K-OCT-5000) представляет собой четырехступенчатую систему на основе HEPES-буфера с пропандиолом и сахарозой в качестве криопротекторов.
Раствор 1. Буфер с 1.0М пропандиолом и 0.3М сахарозой.
Раствор 2. Буфер с 0.5М пропандиолом и 0.3М сахарозой.
Раствор 3. Буфер с 0.3М сахарозой.
Раствор 4. Буфер.
Важно
• Растворы для размораживания должны быть нагреты до комнатной температуры.
• Подготовьте культуральные чашки, содержащие уравновешенную Среду дробления для культивирования размороженных ооцитов в 6% CO2 при 37°C.
• При необходимости подготовьте все для процедуры ИКСИ.
Методика
1. Добавьте по 0.4 мл Раствора 1 в первую лунку четырехлуночного планшета, раствора 2 и 3 в соответствующие лунки планшета и промаркируйте их. Нагрейте растворы до комнатной температуры (~20°C).
2. Промаркируйте 35 мм чашку Петри, содержащую Раствор 4 (для последней инкубации), и нагрейте чашку до комнатной температуры (~20°C).
3. Извлеките соломину(ы) с ооцитами из жидкого азота.
4. Нагревайте соломины в воздухе при комнатной температуре (~20°C) в течение 30 сек.
5. Нагревайте соломину(ы) на водяной бане при 30°C в течение 40 сек.
6. Извлеките соломину(ы) и высушите тканью.
7. Отломите один конец соломины, закрепите на нем шприц и, затем отломите другой конец.
8. Поместите соломину в поле зрения диссекционного микроскопа и удалите содержимое соломин в чашку Петри.
9. Как только ооциты будут визуализированы, их рекомендуется быстро перенести в Раствор 1 в первую лунку планшета.
10. Инкубируйте ооциты последовательно во всех растворах для размораживания в соответствии с таблицей. Старайтесь переносить ооциты, используя минимальный объем растворов, и каждый раз тщательно перемешивайте перенесенный объем с новым раствором.
11. Перенесите ооциты в чашку Петри, содержащую Раствор 4, и поместите чашку на нагревательный столик на 10 мин. при 37°C.
12. В заключение перенесите ооциты в чашку, содержащую уравновешенную Среду дробления (K-SICM), и поместите в инкубатор в 6% CO2 при 37°C на 60 мин. перед проведением ИКСИ или оплодотворением in vitro.
Раствор Время
Раствор 1 5 мин.
Раствор 2 5 мин.
Раствор 3 10 мин.
Раствор 4 10 мин.
Похожие новости:

